lunes, 2 de diciembre de 2013
Enlace Químico
Enlace químico |
Molécula de H2 |
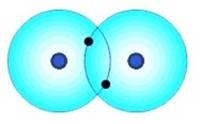
1s1 1s1
|
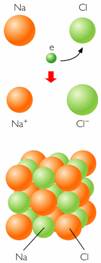 |
| La ilustración describe cristales de Cloruro de sodio (enlace químico iónico). |
Estructura o Notación de Lewis
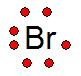 |
viernes, 24 de noviembre de 2006

LOS MINERALES
Un mineral se define como su sustancia homogénea de uno o mas elementos formado de procesos inorgánicos naturales.

Los minerales que estas formados por un solo elementos son llamados elementos nativos que aparecen sin combinarse con otros elementos entre los minerales formado por un solo elemento podemos mencionar el oro (Au), la plata (Ag), el azufre (S), el grafito y el diamante que están formado por carbono (C) y difieren entre si por su estructura.
•Entre los minerales compuesto por dos o mas elemento tiene por Ej.: la pirita, que contiene hierro (Fe) y azufre (S) y su formula es FeS; LA HALITA (sal común) compuesta por sodio (Na) y cloro (Cl.), siendo su formula NaCl y la calcita (Caco3).
•Se pueden encontrar minerales que, debido a su gran estabilidad, han permanecido inalterados los depósitos originales desde que se formaron. Son los minerales primarios, como por ejemplo, el cuarzo. Hay otros minerales primarios que siendo pocos estables pueden sufrir alteraciones químicas por las cuales el mineral primitivo se transforma gradualmente en otro denominado mineral secundario. La galena (PbS) que es un mineral primario, sufre oxidación en el medio ambiente y se puede transformar en anglesita (PbSO4) y cerusita (PbCO3).
¿Qué son los cristales ?
•Un cristal se puede definir como una porción homogénea de materia con una estructura ordenada, definida y con una forma externa limitadas por superficies planas simétricamente dispuestas que son consecuencia del orden interno.
Propiedades físicas de los minerales

1 (Dureza)
Talco (Mineral)
La uña lo raya con facilidad (Comparación)
Yeso
La uña lo raya
Calcita
La punta de un cuchillo lo raya con facilidad
Fluorita
La punta de un cuchillo lo raya
Apatito
La punta de un cuchillo lo raya con dificultad
Feldespato potásico
Un trozo de vidrio lo raya con dificultad
Cuarzo
Puede rayar un trozo de vidrio y con ello el acero despide chispas
Topacio
Puede rayar un trozo de vidrio y con ello el acero despide chispas
Corindón
Puede rayar un trozo de vidrio y con ello el acero despide chispas
Diamante
Puede rayar un trozo de vidrio y con ello el acero despide
chispas
Tenacidad o cohesión:
resistencia que ofrece un mineral a la rotura, deformación, aplastamiento, curvatura o pulverización.
Fractura de un mineral:
 - Exfoliación
- Exfoliación- Laminar o fibrosa
- Concoidea
- Ganchuda
- Lisa
- Terrosa
Clasificación química de los minerales
Los minerales se clasifican en varias clases basándose en su composición química y el tipo de estructura cristalina. Con excepción de los minerales nativos, se agrupan de acuerdo al ión negativo ( anión) presente en la estructura.



Clase-1 (elementos nativos)

 Cobre Nativo y Oro Nativo
Cobre Nativo y Oro NativoClase- 2 (sulfuros)

Antimonita y Pirita
Clase-3 (haluros o halogenuros)

Boleita y Fluorita
Clase-4 (óxidos e hidróxidos)
Crisobeliro y Hematitis con Rutilo
Clase-5 (carbonatos, nitratos, boratos)
Aragonito y Smithsonita
Clase-6 (sulfatos, cromatos, molibdatos y wolframatros)

Baritina y Yeso
Clase-7 (fosfatos, arseniatos, vanadatos)

Apatito y Fosfosiderita
Clase-8 (silicatos)

Augita y Titanita
TRABAJO REALIZADO POR Los alumnos Ortiz, Roa, Ramos, C. Contreras, Vargas y Tapia del 1º A.
martes, 7 de noviembre de 2006
La tierra está formada por capas concéntricas de las cuales las más superficial es la corteza terrestre. Ella está constituida de rocas, que según su origen, pueden clasificarse en ígneas, sedimentarias y metamórficas. Las rocas están constituidas por minerales y éstos por elementos compuestos químicos. Los minerales, en su mayoría se presentan como sólidos cristalinos donde los átomos o moléculas están ordenados en el espacio formando una estructura regular repetida.
Capas de la tierra
La parte superficial de la Tierra llamada Litosfera, conocida también como corteza terrestre, está constituida por rocas. Por datos obtenidos de estudios sismológicos, los geólogos han concluido que la tierra está formada por diferentes capas concéntricas:
a) La corteza que se subdivide en;
Corteza Oceánica (se asienta el océano): Es sólida y esta formada por rocas basálticas (Hierro Fe, carbono C, silicio Si y azufre S)
Corteza Continental (bajo nuestros pies): Es sólida y esta formada por rocas graníticas (Oxígeno O, Si, aluminio Al, Fe y otros en menor proporción)
b) Manto superior e inferior: Es semi líquido y son rocas que contienen Fe, Si, C y S
c) Núcleo externo: Es líquido que contiene Fe y algo de níquel fundidos.
d) Núcleo interno: Sólido formado por una gran esfera de Fe y algo de níquel Ni).
NOTA:
El núcleo de la tierra rota a una velocidad ligeramente mayor que el resto del planeta. Esta diferencia de velocidad haría que en el núcleo de la tierra se genere una corriente eléctrica de gran intensidad y a su vez, generaría el campo magnético.
La litosfera: Esfera de rocas
Esta comprende la corteza terrestre y una pequeña parte del manto, está constituida por una gran variedad de rocas, que no se observan por estar cubiertas de sedimentos ( arena y grava ).
Composición química de la corteza terrestre
El oxígeno constituye casi la mitad de la corteza terrestre y este es su mayor parte se encuentra formando compuesto con el Silicio, este no se encuentra libre en la naturaleza, es decir como elemento, sino formando compuestos químicos que constituyen aproximadamente el 87 % de las rocas.
O( oxígeno): 46% , Si( silicio): 27 %, Al( aluminio): 8,2 %, Fe( hierro): 6,3 %, Ca( calcio): 5%, Mg( magnesio): 2,9 %,K( potasio): 1,5 % y otros 0,8 %
Las Rocas
Una roca es un material natural constituido por minerales en distintas proporciones, los cuales son compuestos inorgánicos. Por ejemplo, el granito contiene cuarzo (dióxido de silicio o sílice, SiO2 ), feldespato, mica negra, caliza ( formada por un solo tipo de mineral) y pequeñas cantidades de impurezas que le dan cualquier color a la roca.
Clasificación de las rocas
Estas se han clasificado de acuerdo a su origen en:
1.- Rocas Ígneas o magmáticas
Formadas por enfriamiento del magma o materia rocosa fundida. Estas se clasifican en dos grupos.
a) Las plutónicas o intrusitas, que se originan cuando el magma se enfría solidifica lentamente y a gran profundidad. Por ejemplo granito, gabros.
b) Las volcánicas o extrusivas, que se forma mediante un proceso de enfriamiento rápido, cuando el magma brota a la superficie en forma de lava, enfriándose en contacto con el agua o aire. Por ejemplo la pumita ( piedra pómez), basalto, obsidiana ( roca negra y brillante es un vidrio)
2.- Rocas Sedimentarias
Se forma por fragmentos de otras rocas que han sufrido proceso de meteorización y erosión ya sea por cambios bruscos de temperatura, por el agua, el hielo o viento. Por ejemplo la caliza, arenisca y arcillas.
3.- Rocas Metamórficas
Se originan a partir de otras rocas ya sea ígneas o sedimentarias, producto del calor opresión. Se caracterizan Portu naturaleza foleada (forma de laminas u hojas).Por ejemplo, el mármol, la cuarcita, las pizarras, esquistos y los gneises.
Ciclo de las Rocas
Las rocas cambian a través del tiempo y se transforman una en otras. Por ejemplo:
- Las rocas ígneas pueden ser meteorizadas y erosionadas y originan sedimentos que forman una roca sedimentaria
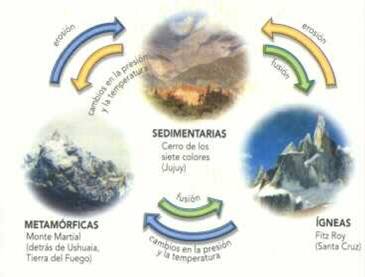
- Las rocas sedimentarias pueden enterrarse a gran profundidad y ser transformada, por efecto del calor y la temperatura en rocas metamórficas.
El Suelo
Es una fina capa de material fértil que cubre la superficie de la tierra. Es una mezcla órgano-mineral porosa que permite el paso del agua y el aire.
La Edafología, es la ciencia que estudia las características de los suelos, su formación y evolución, sus propiedades físicas, químicas morfológicas y su distribución.
En el suelo encontramos material mineral (procedente de roca madre), material orgánico
(Seres vivos y material descompuesto procedente de ellos), agua y aire.
Origen del Suelo
El suelo ha evolucionado y adaptado a los cambios climáticos. Este se formo por la:
Disgregación física de la roca madre bajo influencia de agentes climáticos como viento, lluvia y cambios de temperatura.
Alteración o descomposición química de los minerales que la conforman y por agentes químicos como el CO2 y el O2.
Factores que determinan la formación del suelo (o edafización)
a) La roca: Cualquier tipo de roca puede constituir el material principal o substrato del suelo.
b) Los organismos: La vegetación, fauna y microorganismos forman el material orgánico del suelo.
c) El clima: Regula el aporte de agua como la temperatura
d) La topografía o relieve: influye en la formación del suelo, si este es una zona montañosa u otra.
Características del Suelo
Los procesos de formación del suelo se van produciendo desde la superficie, éste se va estratificando en capas cuyos constituyentes y propiedades varias con la profundidad. A estas capas se les llama horizontes (capa superficial, capa llamada subsuelo, capa de contacto entre el suelo y la roca que lo formo, capa profunda y constituida por la roca madre) y su superposición constituye el perfil del suelo (el estudio del perfil a permitido clasificar los suelos en del mundo de acuerdo a su características)
Propiedades físicas de los suelos
a) Color: El color puede indicar el tipo de suelo
b) Textura (tamaño de las partículas): El suelo esta constituido por partículas de diferentes tamaño y su textura esta determinada por la proporción en que se encuentran las diferentes partículas (de mayor a menor tamaño se tiene los guijarro, grava, arena gruesa, arena fina, limo y arcilla).
c) Estructura (forma de los agregados): Las partículas del suelo no se encuentran aisladas, sino que se agrupan en agregados estructurales llamados peds o terrones, los que se repiten dejando grandes poros entre si. Los agregados pueden ser de distinta forma como migajosa, granular, prismática y laminar.
d) Porosidad: Representa el porcentaje total de espacios libres en el suelo y depende de la textura y estructura.
La acidez de los suelos
La acidez de los suelos esta representada por el contenido de iones de hidrogeno (H+), que se mide en una escala de pH (que toma valores de 0 mas ácido a 14mas básico), mientras mayor sea la concentración de iones mas ácido es el suelo.
La acidez de un suelo influye en sus propiedades. Por ejemplo.
- Si el pH es bajo (muy ácido) hay alteraciones de los minerales.
- Si el pH es alto (muy básico) la arcilla se dispersa destruyendo la estructura del suelo.
- La asimilación de los nutrientes depende del pH del suelo.
- Las mejores condiciones de pH para un suelo varían entre 6 y 7,5.
El nitrógeno del suelo
Los vegetales forman sus proteínas vegetales a partir de los compuestos nitrogenados (amoniaco y sales de amonio producto de la descomposición de excremento animal, plantas y animales muertos; que son transformados en nitratos por bacterias).
La explotación de los suelos a despoblado a este de los contenidos de nitrógeno, se ha hecho necesario el uso de fertilizantes nitrogenados para asegurar la vida vegetal.
La degradación de los suelos
La perdida de la calidad o fertilidad de los suelos pueden reproducirse por causas naturales como la erosión y aumento del contenido salino (salinización).
El hombre ha sido quien ha acelerado estos procesos mediante el uso inapropiado del suelo. Otras de las causas de la degradación es la contaminación con productos tóxicos provenientes de desechos industriales y urbanos.
La erosión es la remoción de las partículas del suelo por efecto de la acción del agua (erosión hídrica) y del viento (erosión eólica). La erosión puede ser geológica o natural y erosión acelerada o antrópica (alteración del suelo por el ser humano) por mal manejo y uso inapropiado del suelo, tala de bosque, los incendios forestales, la quema de rastrojos, construcción de caminos, embalses, etc. que rompen el equilibrio ecológico.
El sobrepastoreo en zonas áridas puede producir desertificación.
Contaminación de los suelos
Todas las sustancias químicas adicionada al suelo pueden cambiar sus propiedades químicas y físicas degradándolo y haciéndolo improductivo si se utilizan en forma inadecuada.

 Por ejemplo, el uso de pesticida, la aplicación de fertilizantes agroquímicos como salitres natural y sintético, los desechos domésticos, residuos industriales y las lluvias ácidas (generadas por la contaminación del aire).
Por ejemplo, el uso de pesticida, la aplicación de fertilizantes agroquímicos como salitres natural y sintético, los desechos domésticos, residuos industriales y las lluvias ácidas (generadas por la contaminación del aire).¿Cuánto sabes?
01.- El suelo se define como:
a) Compuesto de silicio
b) Roca madre
c) Sólido homogéneo
d) Material órgano-mineral
e) Tipos de roca
02.- la degradación de los suelos se produce por:
a) Sólo I I.- Erosión
b) Sólo II II.- Salinización
c) Sólo III III.- Productos Tóxicos
d) I y II
c) I, II y III
03.- ¿Qué características tiene las rocas sedimentarias?
a) Se forman por fragmentos derivados de otras rocas que han sufrido erosión
b) Se forman por acción volcánica
c) Se forman por fragmentación de las rocas depositadas en el fondo marino
d) Se forman en la estratosfera
c) Se forman por enfriamiento de la magna o de minerales fundidos
04.- ¿Son rocas volcánicas o extrusivas?
a) Arenisca
b) Mármol
c) Piedra pómez o pumita
d) Arcilla
e) Cuarcita
05.- ¿Qué capa de la tierra es sólida y contiene Fe y algo de Ni?
a) El núcleo externo
b) La corteza terrestre
c) El núcleo interno
d) La corteza oceánica
e) El manto superior
06.- Las rocas sedimentarias pueden enterrarse a gran profundidad y ser transformadas por efecto del calor y la temperatura, en rocas:
a) Intrusitas
b) Ígneas
c) Sedimentarias
d) Magmática
e) Metamórficas
lunes, 9 de octubre de 2006
HISTORIA
- El hombre paleolítico usaba la brea y alquitrán
- La Biblia también menciona el alquitrán
- Los chinos usaban el gas de petróleo para iluminar
- Los indios americanos usaron el petróleo para permeabilizar sus embarcaciones
- En el renacimiento se destilaba petróleo para obtener lubricantes y productos medicinales.
- La revolución industrial reemplaza el aceite de ballena por aceite combustible para lámparas.
- A. Gessner (1852) obtuvo del petróleo, el queroseno un combustible limpio y barato.
- Sillivan dio a conocer una gran gama de productos que se obtenían de destilar petróleo.
- E. Drake (1859) fue quién perforo el primer pozo petrolífero.
- La invención del automóvil y la primera guerra mundial convirtieron la industria del petróleo en una necesidad energética.
ORIGEN DEL PETRÓLEO
Hay varias teorías que explican el origen del petróleo, algunas son:
a) Hipótesis orgánica de Engler (1911)
Al morir los vegetales y animales (materia orgánica), se acumulo en el fondo marino y se fue mezclando y cubriendo de lodo, tierra y rocas, formando depósitos de sedimentos llamadas roca generadora de crudo. La acumulación de otras capas geológicas genero la roca madre y genero condiciones de alta presión y temperatura lo que facilito la acción de bacterias anaeróbicas que transformo lentamente la materia orgánica en hidrocarburos.
Esta teoría es lamas aceptada ya que en todo yacimiento de petróleo se han encontrado restos de fósiles de animales y vegetales.
b) Hipótesis inorgánica de Mendeléev
El petróleo se origino por la acción de agua sobre carburos metálicos generando metano y acetileno, los demás componentes se generaron por reacciones químicas posteriores.
c) Hipótesis inorgánica de T. Gold (1986)
El gas metano que se encuentra en yacimientos petrolíferos, se genero a partir de meteoritos que cayeron durante la formación de la tierra.
PETRÓLEO (Crudo)
El petróleo esta constituido por una mezcla de compuestos sólidos, líquidos y gaseosos, llamados hidrocarburos (compuestos de carbono e hidrógeno), especialmente del tipo alcano y aromáticos pesados. También pequeñas cantidades de compuestos de nitrógeno, azufre y oxígeno y elementos metálicos en pequeñas cantidades (trazas)
Su color varia de un líquido amarillo pardo a negro y es menos denso que el agua. El petróleo se encuentra junto al gas natural.
COMPOSICIÓN DEL PETRÓLEO
Su composición esta determinada por los tipos de hidrocarburos, según esto los hidrocarburos se clasifican en:
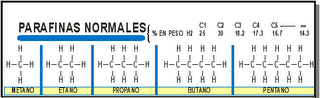
a) Petróleo del tipo parafínico
Es de color claro, fluido de baja densidad, se extrae gran cantidad de gasolina, queroseno y aceite lubricante.
b) Petróleo del tipo asfáltico
Es de color negro, viscoso de elevada densidad, se extrae poca gasolina y aceite lubricante. Deja un residuo asfáltico.
c) Petróleo de base mixta
Tiene características y rendimiento entre las otras dos categorías.
HIDROCARBUROS
Son compuestos orgánicos formados solo por átomos de carbono y hidrógeno. Se clasifican en alifáticos aciclicos (alcanos, alquenos y alquinos), alifáticos cíclicos ( cicloalcanos, cicloalqueno y cicloalquinos) y aromáticos ( bencenos y sus derivados ).

REFINACION DEL PETRÓLEO
- Se extrae mediante profundas perforaciones del mar o tierra
- Debe ser refinado (separar las fracciones) para ser usado como fuente de energías materia prima.
- El crudo extraído se transfiere a depósitos donde se separa el agua, residuos sólidos y gasa natural
- Finalmente es transportado a las refinerías
FRACCIONAMIENTO DEL PETRÓLEO
- En torres de fraccionamiento existentes en las refinerías, el petróleo es sometido a destilación fraccionada, conocido como proceso de Topping o destilación primaria.
-La separación es por diferencia en los puntos de ebullición de las mezclas líquidas
- En la refinería el petróleo se bombea continuamente y se calienta a entre 370 y 400º C en calderas.
- El vapor de petróleo asciende por la columna de fraccionamiento ( las fracciones mas livianas se condensan en la parte alta de la columna y las fracciones mas pesadas en la parte baja )
FRACCIONES

a) Gas (menos de 40ºC , hidrocarburos de 1 a 4 átomos de carbono)
- Metano y etano se comercializan como gas de cañería (gas natural)
- Propano y butano se licuan para ser comercializados en bidones como gas licuado
b) Gasolina (40 -200ºC, de 5 a 12 átomos de carbono)
- Se utiliza en motores de combustión interna y como disolvente industrial
- No se puede usar en automóviles tal como se extrae desde la columna de fraccionamiento
c) Queroseno (200- 300ºC, de 12 a 16 átomos de carbono)
- Se llama parafina líquida, usado en lámparas y estufas
- Es la base para el combustible para aviones de reacción (gas avión)
d) Gasóleo (250- 350 ºC, de 15 a 18 átomos de carbono)
- Se obtiene el combustible Diesel para motores de tractor, locomotoras, camiones y barcos.
- Útil en calderas, calefacción domestica e industrial, motores de termoeléctricas.
e) Aceite lubricante (300 -370º C, de 18 a 20 átomos de carbono)
- Para prepara lubricantes
f) Residuos (fuel oil o aceite combustible)
- Hidrocarburos con más de 20 átomos de carbono que no seevaporar a 370 º C
- Se vuelve a destilar, obteniéndose un destilado (lubricantes para motores de aviones, parafina sólida, vaselina y materia prima para preparar mas gasolina y Diesel) y residuo (asfalto y coque)
MAREA NEGRAS
Derrame accidental de petróleo en el mar. El derrame produce daño ala vida marina, destruye el plancton, causa la muerte de peces, crustáceos y aves.
Los hidrocarburos más livianos se evaporar rápidamente pero los mas pesados flotan sobre la superficie del mar llegando a la costa.
DERIVADOS DEL PETRÓLEO
Los combustibles más importantes para la sociedad actual es la gasolina y el Diesel.
1) LA GASOLINA
- El motor de los automóviles son de combustión interna o explosión
- La mezcla de aire y vapor de gasolina en el cilindro del motor se comprime por el pistón.
- Una bujía enciende la mezcla expulsando el pistón que mueve el eje del motor.

INDICE DE OCTANO U OCTANAJE
- La gasolina es una mezcla de hidrocarburos.
- El índice de octano de una gasolina es una medida de su capacidad antidetonante.
- Las características detonantes de una gasolina se determinan comparándola con una mezcla de n-heptano e isooctano (2,2,4-trimetilpentano )
- El n-heptano: índice de octano 0 (más detonante/ cadena lineal)
- El isooctano o 2,2,4-trimetilpentano: índice de octano 100 ( menos detonantes/ cadena ramificada )
- Si las características de una gasolina son idénticas a la de una mezcla de 97 % de isooctano y 3 % de n-heptano, se le asigna un índice de octano de 97.
- En general los hidrocarburos mas ramificados y los aromáticos tienen índice de octano mayores que los de cadena lineal.
GASOLINA COMERCIAL
- Es una mezcla de gasolina natural y gasolina obtenida de otras fracciones, mediante procesos de craking, polimerización o isomerización.
- Para elevar el octanaje de la gasolina se agrega antidetonantes como; tetraetilplomo (TEP), lo que se llama gasolina con plomo.
- El TEP está prohibido por ser tóxico y se elimina por el tubo de escape del automóvil sustancias con plomo
- La gasolina con plomo genera contaminación ambiental con plomo
- Los hidrocarburos no quemados de la gasolina generan CO (monóxidos de carbono) y
NO x (óxidos de nitrógenos)
CONVERTIDORES CATALITICOS
- Estructura de cerámica impregnada de alumina ( Al2O3 ) y metales como Pt ( platino ), Pa ( paladio ) y Ro ( rodio ) que actúan como catalizadores.
- Su función es transformar los gases tóxicos de la combustión como CO y NOx en gases menos tóxicos como CO2, N2 y agua.
2) COMBUSTIBLE DIESEL
- Se obtiene del gasóleo (15 a 18 átomos de carbono)
- El Diesel es más pesado y aceitoso
- Se evapora más lento y su punto de ebullición es alto
- Más económico porque requiere menos refinación
MOTOR DIESEL
- Se comprime solo el aire elevándose la temperatura aproximadamente a 500ªC, luego se inyecta al aire comprimido el diesel y este se inflama.
- El Diesel es usado en motores de locomotoras, camiones, tractores, barcos, etc.
INDICE DE CETANO
- Es una medida de la tendencia del Diesel a inflamarse espontáneamente.
- El índice de cetano esta referido a una mezcla de n-hexadecano o cetano (índice de cetano 100) y alfa-metilnaftaleno (índice de cetano 0)
PETROQUIMICA
- Del 100 % del petróleo refinado el 90 % es para combustible y el 10 % es para la industria de la petroquímica.
-Mediante diversos procesos químicos la industria de la petroquímica obtiene productos para la vida cotidiana o materia prima como: plásticos, resinas, caucho, fibras sintéticas, fertilizantes, colorantes, material de construcción, explosivos, productos farmacéuticos, alimentos, adhesivos, perfumes, saborizantes , etc.
-Los hidrocarburos más importantes para la industria de la petroquímica son los alquenos ( eteno o etileno ,propeno, butenos ) y los aromáticos ( benceno y tolueno ).
EN CONSECUENCIA, el petróleo
- Es un recurso no renovable ( se agotará algún día )
- Su combustión genera problemas ambientales
- Se acabará la industria de la petroquímica
- Es necesario buscar otras fuentes de energía como; eléctrica, geotérmica, eólica, nuclear, biomasa (se produce por leña, aserrín, papeles, cartones, desechos agrícolas) o biogás (descomposición de desechos orgánicos que generan gas metano).
domingo, 27 de agosto de 2006
CAPITULO 3: La composición del aire y las capas de la atmósfera
1.- La composición del aire
El aire es una mezcla de gases cuyos componentes fundamentales son el Nitrógeno 78,1 % (N2) y el Oxígeno 20,9 % ( 0 2 ) y que corresponden al 99 % del aire seco. El 1 % del aire esta formado por los componentes secundarios: dióxido de carbono ( CO2), hidrógeno ( H2), metano( CH4) y gases nobles
como argón ( Ar), neón ( Ne ), helio ( He ), kriptón ( Kr ) y xenón ( Ne). A nivel de trazas ( pequeña cantidades ) monóxido de nitrógeno ( NO), dióxido de nitrógeno ( NO2), ozono ( 03), dióxido de azufre ( SO2 ), amoniaco ( NH3 ) y monóxido de carbono ( CO ).
La proporción de estos gases es más o menos constante hasta los 25 km. de altitud, aunque se concentración disminuye con la altura, excepto el ozono y los compuestos de nitrógeno, cloro y azufre. Además existe dos componentes en cantidades variables como son el:
* Agua en sus tres estados físicos
* Polvo atmosférico formado por humo, sal, arena fina, cenizas, esporas, polen,
microorganismo, etc.
2.- Origen de al atmósfera
En su forma primitiva la atmósfera debió estar compuesta por una parte de emanaciones volcánicas producto de las erupciones y material del interior de la tierra. Los componentes gaseosos de estas emanaciones fueron: el vapor de agua ( H 20 ), sulfuro de hidrógeno( H2 S), cloruro de hidrógeno ( HCl ) y nitrógeno ( N2 ). A través de varios procesos la atmósfera primitiva sufrió:
* La condensación que dio origen a los antiguos océanos
* El dióxido de carbono (CO2) reacciono con las rocas de la corteza terrestre para
formar carbonatos, algunos de los cuales se disolvieron en los océanos.
* Evolución de la vida primitiva en los océanos
* Los organismos fotosintéticos comenzaron a consumir dióxido de carbono (CO2) y
producir oxigeno (0 2).
3.- Características de los gases de la atmósfera
a) Nitrógeno (N2): Molécula biatómica, compuesto más abundante del aire, poco reactivo
(forma óxidos a elevadas temperaturas ), gas inerte, no es toxico, incoloro, insípido, diluye
a los demás compuestos del aire, los compuestos de nitrógeno son componentes vitales en los alimentos ( por ejemplo en moléculas biológicas como las proteínas ), fertilizantes y explosivos, y puede licuarse a temperaturas muy bajas ( se usa para congelar muestras biológicas o en técnicas de reproducción asistida )
b) Oxígeno ( 02 ): Gas incoloro, inodoro, insípido, relativamente no toxico ( puro es toxico se inhala en grandes cantidades ), proviene de la fotosíntesis, es fundamental en las reacciones de combustión, muy reactivos ( forma óxidos ), forma parte del agua y es necesario para la respiración de plantas y animales ( combustión celular )
Combustión: Combustible + 0 2(g) _____ Óxidos + calor y/o luz
Respiración es una combustión lenta: Azúcar + O2(g) ___ CO2(g) + H2O + Energía
c) Gases Nobles: Su abundancia en la tierra es baja, poco reactivos (capa electrónica cerrada), evita la oxidación del filamento de las ampolletas
d) Dióxido de carbono (C02): Gas incoloro, inodoro y no toxico ( en altas concentraciones y por falta de oxigeno produce efectos nocivos y asfixia ), a bajas concentraciones de oxigeno se produce una mezcla de dióxido de carbono y monóxido de carbono ( C0 ). Se obtiene dióxido de carbono (CO2) por:
* Combustión en presencia de oxigeno de cualquier sustancia que
contenga carbón. C + 0 2(g) ______ CO2(g)
* Calentamiento de carbonatos a elevadas temperaturas
* Reacción con ácidos de los carbonatos
* Fermentación de azucares y vegetales
* Metabolismo celular
e) Agua (H20): Forma parte del aire en sus tres estados. Su papel es fundamental en la atmósfera ya que influye en: los fenómenos atmosféricos y en las características del clima
f) Monóxido de carbono ( CO ) : Es muy toxico, peligroso , se obtiene por combustión incompleta del carbono, es incoloro, inodoro e insípido
4.- Capas de la atmósfera
En la atmósfera terrestre se pueden distinguir capas que difieren en cuanto a composición, temperatura y presión
Zona
Altura ( Km )
Troposfera
0 - 18
Estratosfera
18 - 50
Mesosfera
50 - 80
Ionosfera / termosfera
80 - 630
Exosfera
Sobre 630
5.- Características de las capas
a) Troposfera: Capa inferior de la atmósfera, mas próxima a la superficie terrestre, contiene el 90 % se los gases atmosféricos, la temperatura disminuye con la altitud, se desarrollan corrientes verticales de aire que dan origen a nubes y los fenómenos atmosféricos ( lluvia, vientos, etc.), ocurren los fenómenos biológicos ( dispersión del polen, semillas, vuelos de pájaros e insectos, etc.) y su espesor varia con la altitud, siendo máxima en el ecuador y mínima en los polos.
b) Estratosfera: Se distinguen dos capas una de 18 a 30 Km. donde la temperatura permanece constante entre - 50 ° C y – 40 ° C y otra de 30 a 50 Km. donde la temperatura aumenta hasta alrededor de 0 ° C. Las partículas contaminantes permanecen mucho tiempo en ella por los vientos horizontales de las masas de aire y contiene la capa de ozono entre los 18 a 25 Km. de altura (llamado ozono estratosférico que se produce y destruye por reacciones químicas y que tiene gran poder de absorción de los rayos ultravioleta solares, de manera que protege a la superficie terrestre de sus efectos).
c) Mesosfera: La temperatura disminuye drásticamente con la altura y el aire es poco denso y frío, predominando los gases ligeros.
d) Ionosfera o termosfera: La temperatura aumenta hasta alcanzar los 1200 ° C, las radiaciones solares y la lluvia de electrones procedentes del sol ionizan los gases atmosféricos (átomos y moléculas se cargan eléctricamente).
e) Exosfera: Zona de transito entre la atmósfera terrestre y el espacio interplanetario.
CAPITULO 4: Los enemigos de la atmósfera
El crecimiento de la población humana y el desarrollo tecnológico afectan al medio ambiente, produciendo una disminución cada vez acelerada de la calidad de este y de su capacidad para sustentar la vida.
1.- Efecto invernadero:
La energía del sol llega a la tierra que a su vez la irradia de vuelta al espacio, sin embargo los gases de la atmosfera como el vapor de agua, el dióxido de carbono (CO2 ) y otros, atrapan parte de esta energía y mantienen el calor del planeta produciendo un efecto invernadero natural, sin este efecto la temperatura de la tierra seria mucho menor y probablemente la vida tal como la conocemos no existiría.
Cuando aumenta la concentración de estos gases, sobre todo del CO2 que forma los invernaderos naturales, se rompe el equilibrio, impidiendo que el exceso de calor irradiado por la tierra sea eliminado hacia la estratosfera.
La concentración de los gases que forman el efecto invernadero aumenta cuando se:
* Usa combustibles fósiles (petróleo, carbón y derivados de la hulla) en motores de combustión interna, en los procesos industriales y la quema de bosques (impide que estos vegetales transformen el dióxido de carbono en oxigeno a través de la fotosíntesis).
* Generan otros gases como el óxido de dinitrógeno (N2O) , metano ( CH4 ) y los clorofluocarbonos ( CFC-11 y CFC- 12 ) usados en aerosoles, sistemas de refrigeración, aire acondicionados y espumas plásticas.
Un aumento del efecto invernadero puede producir:
* Un aumento importante de la temperatura del planeta (calentamiento global de la atmósfera ), produciendo una grave amenaza para el ser humano y demás seres vivos del ecosistema terrestre.
* Derretimiento de hielos polares que provocarían un aumento del agua oceánica e importante cambios en el clima (aumento de lluvias, sequías, etc.)
2.- Capa de Ozono (Ozono estratosférico)
Es un gas compuesto de tres átomos de oxigeno (02 ), cuyas moléculas son muy reactivas que se producen naturalmente en la estratosfera a 40 Km. de altura y se le denomina ozono estratosférico.
Su función es servir de filtro de las radiaciones solares, absorbiendo la radiación ultravioleta UV que es perjudicial para la vida (sin esta capa seria imposible la vida sobre nuestro planeta ).
La concentración de ozono permanece constante ya que se recupera manteniéndose el equilibrio.
0 + UV ______ 0 + 02
02 + UV ______ 0 + 0
0 + 02 ______ 03 (molécula de ozono)
El equilibrio se rompe por el uso de CFC (que contienen cloro, fluor y carbono) que reaccionan con el ozono, produciéndose un adelgazamiento de la capa que llevaría a un exceso de radiaciones ultravioleta UV ( puede producir cáncer a la piel , cataratas, reducir la respuesta del sistema inmunitario, interferir en el fotosíntesis y fitoplancton e interferir en la estabilidad del clima )
Cl + 03 ________ Cl0 + 02
02 + UV ________ 0 + 0
Cl0 + 0 ________ Cl + 02
Cada molécula de cloro destruye
unas 100.000 moléculas de ozono
3.- Ozono troposférico
Forma parte del smog fotoquímico que se produce en la superficie terrestre por acción de la luz solar con los gases emitidos por los motores de combustión interna, industria y plantas de energía. Se forma en días calidos, asoleados y sin viento, siendo muy tóxico, irritante para nariz, ojos, garganta y bronquios.
4.- Lluvia ácida
El uso de combustibles fósiles por motores de combustión internas, centrales eléctricas, calderas industriales y plantas de fundición producen dióxido de azufre ( SO2 ) y óxidos de nitrógenos, que interactúan con la luz solar, la humedad y el oxigeno atmosférico, produciéndose ácido sulfúrico ( H2SO4 ) y ácido nítrico (HNO3) que caen a la tierra arrastrados por la lluvia y la nieve.
SO2(g) + O2(g) _____ SO3(g)
SO3(g) + H 2O(l) _____ H2 S O4(l)
La precipitación de estos ácidos, producen cambios en el grado de acidez ( pH ) del suelo y del agua, afectando los cultivos, construcciones y en general el equilibrio de la naturaleza.
1.- Transforme:
a) 25 ° C a ° K
b) - 10° C a ° K
c) 550 ° K a ° C
d) 3,4 atm a mm de Hg
e) 670 mm de Hg a atm
f) 0° C a ° K
g) 750 mm de Hg a Kpa
h) 3,4 atm a Kpa
2.- 12 dm3 de un gas soportan una presión de 1,2 atm.¿ Cuál será el volumen que ocupará esta misma masa de gas si, manteniéndose la temperatura constante, se la lleva a una presión de 1,8 atm? R = 8 dm3
3.- Un gas ocupa un volumen de 50 dm3 medidos s una temperatura de 20° C¿ Quévolumen ocupará a 5° C, si la presión se mantiene constante? R = 47,44 lt.
4.- A 20 ° C una cierta masa gaseosa soporta una presión de 8 atm. Si se la calienta hasta llegar a una temperatura de 80° C ¿Cuál será la presión, suponiendo que el volumen permaneció constante? R = 9,63 atm.
5.- ¿A qué temperatura se hallan 12 moles de moléculas de un gas, sometidos a una presión de 4 atmósferas en un recipiente de 21 dm3? R = 85,36 ° K
6.- Para un mol de gas en CNPT determine la constante universal de los gases R.R = 0,082 atm dm3/ mol ° K
7.- Un gas ocupa un volumen de 500 lt a 10 atm de presión. Si la temperatura permanece constante.¿Cuál será su volumen a la presión de 2,4 atm? R = 2083,33 lt
8.- En un recipiente se encuentra cierta masa de un gas a una temperatura de – 10° C y la presión de 1,6 atm. Si se mantiene constante el volumen y se lleva el gas hasta 35° C ¿Cuál será la nueva presión que soportará? R = 1,87 atm
9.- Un recipiente contiene 10 dm3 de oxígeno a 5° C ¿ A qué temperatura se duplicará el volumen del gas, si se mantiene la presión constante? R = 556° K
10.- Para cierto estado de un gas la expresión PV/T vale 4,1 dm3 atm /° K ¿Cuántos moles de moléculas constituyen la masa gaseosa? R = 50 moles
11.- Se almacena CO2 en un recipiente de 10 dm3 a 5° C y 1,2 atm. Calcular los moles de moléculas del gas. R = 0,52 moles -6
12.- Hemos recogido un gas a la presión de 1,55x10 mm de Hg que ocupa 250 cc. Suponiendo que se comporta idealmente ¿Qué volumen ocuparía este gas si se Comprime hasta 1 atm a la misma temperatura? R = 5,1 x 10
13.- ¿Qué volumen ocupan 2,3 moles de HCl medidos en CNPT?¿ Qué volumen a 25° C y 720 mm de Hg? R = 51,48 lt y 59,16 lt
14.- ¿Qué presión en mm de Hg ejercerá 0,25 moles de CO a 75° C encerrados en un recipiente de 30 lt? R = 180,7 mm de Hg
15.- Se almacenan 25 dm3 de oxígeno a 35° C en un cilindro de acero a 2,3 atm ¿Cuántos moles hay?
16.- Un cilindro de acero se llena de un gas a 27° C y 10 atm de presión. Si la temperatura se duplicará, la nueva presión será. R = 10,9 atm
17.- ¿Cuáles son propiedades características del estado gaseoso?
- Toma el volumen y la forma del recipiente que lo contiene
- Fácil de comprimir
- Difunde rápidamente
- Densidad alta
- Fluye fácilmente







